Từ giải trình tự protein đến kính hiển vi điện tử, từ khảo cổ học đến thiên văn học, dưới đây là bảy công nghệ có khả năng tạo ra đột phá trong phát triển KH&CN.

Gương chính của Kính viễn vọng Không gian James Webb (trong ảnh là 6 trong số 18 tấm gương) có thể phát hiện các vật thể cách xa hàng tỷ năm ánh sáng. Nguồn: NASA/MSFC/David Higginbotham
1. Kính thiên văn vũ trụ James Webb
Sau hơn hai thập kỷ thiết kế và xây dựng, NASA – phối hợp với các cơ quan vũ trụ của châu Âu và Canada – đã phóng thành công Kính viễn vọng Không gian James Webb (JWST) lên quỹ đạo vào ngày 25/12/2021. Sau đó bảy tháng, kính viễn vọng mở ra và tự định hướng cho đợt quan sát đầu tiên của nó.
Matt Mountain, nhà thiên văn học tại Viện Khoa học Kính viễn vọng Không gian ở Baltimore, Maryland, và nhà khoa học kính viễn vọng cho dự án JWST, cho biết những hình ảnh ban đầu vượt quá mong đợi. “Thực sự không có khoảng trời nào trống rỗng — các thiên hà ở khắp mọi nơi,” ông thốt lên. “Về mặt lý thuyết, chúng tôi biết điều đó, nhưng khi được tận mắt nhìn thấy những hình ảnh, nó vẫn mang lại cảm xúc rất khác”.
JWST được thiết kế để “bù đắp” cho Kính viễn vọng Không gian Hubble. Hubble đã tạo ra những góc nhìn tuyệt đẹp về vũ trụ nhưng vẫn có những điểm mù: về cơ bản, nó không thể nhìn thấy được các ngôi sao và thiên hà cổ đại với các tín hiệu ánh sáng trong phạm vi hồng ngoại. Điều này đòi hỏi các nhà khoa học phải tạo ra một thiết bị quan sát vũ trụ có độ nhạy lớn với một dải bước sóng hồng ngoại rất rộng, có thể nhận dạng các tín hiệu hồng ngoại cực kỳ yếu, cách xa hàng tỷ năm ánh sáng.
Cuối cùng, NASA đã tạo nên một JWST gồm 18 tấm gương lục giác làm từ beryli nhẵn hoàn hảo và khi kính viễn vọng tự mở ra hoàn toàn, nó sẽ có đường kính 6,5 mét. Mountain cho biết, những tấm gương đó được thiết kế chính xác đến mức “nếu bạn kéo căng, trải một tấm ra khắp diện tích Hoa Kỳ, không có phần lồi lõm nào cao hơn năm cm.” Chúng được kết hợp với các máy dò bước sóng cận và trung hồng ngoại tiên tiến nhất.
Thiết kế đó cho phép JWST bổ khuyết cho Hubble, bao gồm cả việc thu thập các dấu hiệu của một thiên hà 13,5 tỷ năm tuổi đã tạo ra một số nguyên tử oxy và neon đầu tiên trong vũ trụ. Mikako Matsuura, nhà vật lý thiên văn tại Đại học Cardiff, Anh, đang thực hiện hai nghiên cứu với JWST, xem xét quá trình tạo thành và phá hủy bụi vũ trụ có thể góp phần hình thành sao và hành tinh như thế nào. Matsuura nói, “Chúng tôi đã thấy những hiện tượng hoàn toàn khác xảy ra bên trong những vật thể này — thật quá đỗi kinh ngạc”.
2. Giải trình tự protein đơn phân tử
Hệ protein (proteome), một tập hợp hoàn chỉnh các protein được một tế bào hoặc sinh vật tạo ra, có thể cung cấp cho chúng ta những thông tin sâu sắc về sức khỏe và bệnh tật. Tuy nhiên, việc mô tả các đặc trưng của hệ protein vẫn còn là một thách thức.
Hầu hết các phân tích hệ protein đều phải sử dụng phép đo khối phổ, một kỹ thuật lập hồ sơ các protein được trộn lẫn dựa trên khối lượng và điện tích của chúng. Thông qua những hồ sơ này, có thể định lượng được hàng nghìn protein cùng một lúc nhưng không phải lúc nào cũng có thể xác định rõ ràng các phân tử được phát hiện, và thường dễ bỏ qua các protein số lượng ít trong hỗn hợp. Giờ đây, các công nghệ đơn phân tử có thể giải trình tự được nhiều, nếu không muốn nói là tất cả, các protein tồn tại trong một mẫu.
Edward Marcotte, nhà hóa sinh tại Đại học Texas ở Austin, đang theo đuổi một phương pháp như vậy, giải trình tự phát huỳnh quang (fluorosequencing). Kỹ thuật của anh, được công bố vào năm 2018, dựa trên một quy trình hóa học gồm nhiều bước: trước tiên đánh dấu huỳnh quang các acid amin riêng lẻ, sau đó cắt từng acid một từ phần cuối của protein liên kết bề mặt khi máy ảnh bắt được tín hiệu huỳnh quang. Năm ngoái, các nhà nghiên cứu tại Quantum-Si, một công ty công nghệ sinh học ở Guilford, Connecticut, đã mô tả một giải pháp thay thế cho giải trình tự phát huỳnh quang: sử dụng các protein ‘liên kết’ được dán nhãn huỳnh quang để nhận ra các chuỗi acid amin (hoặc polypeptide) cụ thể ở phần cuối của protein.
Các nhà nghiên cứu khác đang phát triển các kỹ thuật mô phỏng trình tự DNA chứa nanopore (một lỗ nhỏ có kích thước chỉ vài nanomet), định hình các polypeptide trên cơ sở những thay đổi tạo ra trong dòng điện khi chúng đi qua các kênh nhỏ. Nhà sinh lý học Cees Dekker thuộc Đại học Công nghệ Delft ở Hà Lan và các cộng sự đã công bố một phương pháp như vậy vào năm 2021. Họ sử dụng các nanopore làm từ protein và có thể phân biệt giữa các acid amin riêng lẻ trong một polypeptide đi qua lỗ. Tại Viện công nghệ Technion Israel ở Haifa, nhóm nghiên cứu của kỹ sư y sinh Amit Meller đang nghiên cứu các thiết bị nanopore trạng thái rắn được sản xuất từ vật liệu dựa trên silicon, giúp phân tích thông lượng cao nhiều phân tử protein riêng lẻ cùng một lúc.
Mặc dù hiện tại giải trình tự protein đơn phân tử mới chỉ dừng lại là một ý tưởng được chứng minh hiệu quả từ các dự án thử nghiệm, nhưng quá trình thương mại hóa đang diễn ra nhanh chóng. Marcotte, người đồng sáng lập công ty giải trình tự protein Erisyon ở Austin, Texas, tỏ ra lạc quan. “Vấn đề không phải là liệu nó có hoạt động hiệu quả hay không,” ông nói, “mà là sẽ mất bao lâu để đưa nó đến tay mọi người.”
3. Kính hiển vi điện tử khối
Kính hiển vi điện tử (EM) được biết đến với độ phân giải vượt trội, nhưng chủ yếu ở cấp độ bề mặt của mẫu. Để nhìn sâu hơn bên trong, các nhà khoa học phải phân đoạn mẫu vật thành những lát mỏng đặc biệt. Tuy nhiên, các mẫu vật của các nhà sinh vật học thường không đủ để thực hiện nghiên cứu. Lucy Collinson, một nhà kính hiển vi điện tử tại Viện Francis Crick ở London, giải thích rằng có thể mất 200 đoạn để bao phủ thể tích của chỉ một tế bào. Giờ đây, các nhà nghiên cứu đang đưa độ phân giải EM vào các mẫu mô 3D bao gồm nhiều milimet khối.
Trước đây, việc tái tạo lại các khối như vậy từ hình ảnh EM 2D — chẳng hạn, để lập biểu đồ kết nối thần kinh của não — đòi hỏi một quá trình chuẩn bị mẫu, chụp ảnh và tính toán tỉ mỉ để biến những hình ảnh đó thành một ngăn chồng chồng lớp lớp nhiều hình ảnh. Mỗi kỹ thuật đều có những ưu điểm và hạn chế khác nhau. Hình ảnh mặt khối nối tiếp, sử dụng lưỡi cắt kim cương để cạo các lớp mỏng liên tiếp của mẫu được nhúng nhựa khi nó được chụp trên các mẫu có kích thước gần một milimet khối. Tuy nhiên, độ phân giải độ sâu của nó kém, có nghĩa là kết quả tái tạo khối sẽ tương đối mờ. Kính hiển vi điện tử quét chùm ion hội tụ (FIB-SEM) tạo ra các lớp mỏng hơn nhiều — và do đó độ phân giải độ sâu tốt hơn — nhưng phù hợp hơn với các mẫu có thể tích nhỏ hơn.
Collinson coi sự tiến triển của EM khối như một “cuộc cách mạng thầm lặng”. Vào năm 2021, các nhà nghiên cứu làm việc trong sáng kiến Phân đoạn Bào quan trong Kính hiển vi Điện tử (COSEM) tại Cơ sở nghiên cứu Janelia ở Ashburn, Virginia, đã xuất bản hai bài báo trên tạp chí Nature nhằm nêu bật những tiến bộ quan trọng đạt được trong việc lập bản đồ bên trong tế bào.
Sáng kiến COSEM sử dụng các kính hiển vi FIB-SEM tinh vi, được thiết kế riêng để tăng thể tích mẫu, qua đó có thể chụp ảnh trong một thử nghiệm đơn lẻ lên khoảng 200 lần, đồng thời vẫn duy trì được độ phân giải không gian rõ nét. Bằng cách sử dụng một loạt các kính hiển vi này kết hợp với các thuật toán học sâu, nhóm đã có thể xác định những bào quan khác nhau và các cấu trúc dưới tế bào trong khối 3D đầy đủ của nhiều loại tế bào.
Các phương pháp trên đòi hỏi nhóm nghiên cứu phải tốn nhiều thời gian lẫn công sức để chuẩn bị mẫu, thu thập một lượng lớn dữ liệu, đồng thời rất khó để thành thạo. Tuy nhiên nỗ lực này rất đáng giá: Collinson có được những hiểu biết chuyên sâu trong nghiên cứu bệnh truyền nhiễm và sinh học ung thư. Cô hiện đang làm việc với các đồng nghiệp để khám phá tính khả thi của việc tái tạo toàn bộ não chuột ở độ phân giải cao — một nỗ lực mà cô dự đoán sẽ mất hơn một thập kỷ, tiêu tốn hàng tỷ USD và tạo ra nửa tỷ gigabyte dữ liệu. “Có lẽ công sức mà chúng tôi sẽ phải bỏ ra cũng tương tự như nỗ lực lập bản đồ bộ gene người đầu tiên”, cô so sánh.
4. CRISPR được áp dụng khắp mọi nơi
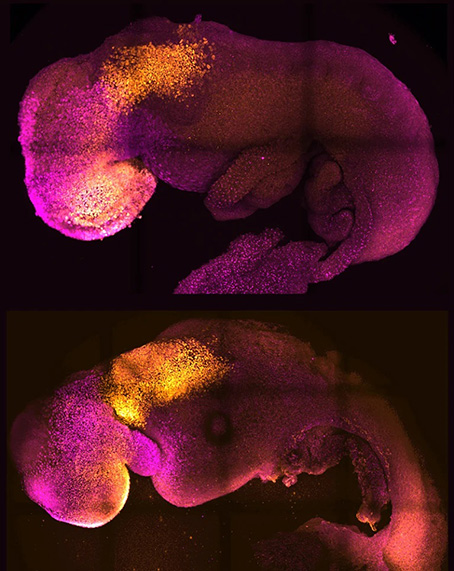
Các nhà nghiên cứu hiện có thể tạo ra các phôi tổng hợp trong phòng thí nghiệm (dưới) giống với phôi tự nhiên, 8 ngày tuổi (trên). Nguồn: Phòng thí nghiệm Magdalena Zernicka-Goetz
Công nghệ chỉnh sửa hệ gene CRISPR–Cas9 nổi tiếng là phương pháp thường được sử dụng để tiến hành những thay đổi cụ thể tại các vị trí được nhắm đích trong toàn bộ bộ gene, thúc đẩy những đột phá trong liệu pháp gene, mô hình hóa bệnh và các lĩnh vực nghiên cứu khác. Tuy nhiên, nó vẫn có một số giới hạn khi áp dụng. Giờ đây, các nhà nghiên cứu đang tìm cách khắc phục những hạn chế đó.
Việc chỉnh sửa CRISPR diễn ra với sự hỗ trợ của một RNA dẫn đường ngắn hướng một enzyme nuclease Cas liên quan đến giải trình tự bộ gene đích của nó. Nhưng enzyme này cũng yêu cầu một trình tự liền kề được gọi là motif liền kề protospacer (PAM); không có nó, quá trình chỉnh sửa có thể thất bại. Các yêu cầu PAM ít nghiêm ngặt như trên làm tăng cơ hội chỉnh sửa “ngoài mục tiêu”, nhưng kỹ thuật mới còn có thể cải thiện tính đặc hiệu của chúng. Nhóm của Kleinstiver đang phát triển một phương pháp mới – thiết kế và thử nghiệm số lượng lớn các biến thể Cas9 có tính đặc hiệu cao đối với các trình tự PAM riêng biệt.
Ngoài ra, có nhiều biến thể Cas xuất hiện tự nhiên vẫn chưa được khám phá. Về bản chất, hệ thống CRISPR–Cas9 là một cơ chế bảo vệ vi khuẩn chống lại sự lây nhiễm virus, và các vi sinh vật khác nhau đã phát triển các loại enzyme với các ưu tiên PAM riêng biệt. Nhà virus học Anna Cereseto và nhà nghiên cứu hệ vi sinh vật Nicola Segata tại Đại học Trento (Ý) đã nghiên cứu hơn một triệu bộ gene của vi sinh vật để xác định và mô tả một tập hợp các biến thể Cas9 đa dạng mà họ ước tính nhắm đến hơn 98% đột biến gây bệnh ở người.
Tuy nhiên, chỉ một số ít [các enzyme này] sẽ hoạt động trong tế bào động vật có vú. “Ý tưởng của chúng tôi là thử nghiệm nhiều loại và xem đâu là yếu tố quyết định giúp các enzyme đó hoạt động bình thường”, Cereseto nói. Với những kết quả được thu thập từ các nhóm enzyme tự nhiên này và kỹ thuật protein thông lượng cao, Kleinstiver cho biết: “Tôi nghĩ chúng ta sẽ có được một hộp công cụ khá hoàn chỉnh với các công cụ chỉnh sửa cho phép chúng ta chỉnh sửa bất kỳ base (các phân tử cấu tạo DNA) nào chúng ta muốn”.
5. Xác định niên đại bằng carbon phóng xạ có độ chính xác cao
Năm 2022, các nhà khảo cổ học đã tận dụng những tiến bộ trong việc xác định niên đại bằng carbon phóng xạ để xác định chính xác niên đại, thậm chí cả thời gian người Viking lần đầu đặt chân đến châu Mỹ. Dựa trên nghiên cứu về những khúc gỗ được khai quật ở bờ biển phía Bắc Newfoundland (Canada), một nhóm nghiên cứu do chuyên gia phân tích đồng vị Michael Dee tại Đại học Groningen (Hà Lan) và nghiên cứu sinh sau tiến sĩ Margot Kuitems đã xác định những cây gỗ này có thể bị chặt vào mùa xuân năm 1021.
Họ đã áp dụng phương pháp xác định niên đại bằng carbon phóng xạ cho những di vật hữu cơ từ những năm 1940 để xác định cụ thể hơn thời gian diễn ra của các sự kiện lịch sử. Các nhà khoa học đã đo vết đồng vị carbon-14, được hình thành từ tương tác của tia vũ trụ với khí quyển Trái đất và phân rã chậm qua hàng thiên niên kỷ. Nhưng kỹ thuật này đem lại những mốc thời gian xê xích vài thập kỷ.

Xác định niên đại của gỗ bằng đồng vị carbon chính xác tại L’Anse aux Meadows, Newfoundland, Canada, tiết lộ thời điểm người Viking hạ cây ở đây vào năm 1021. Nguồn: All Canada Photos/Alamy
Mọi thứ đã thay đổi vào năm 2012, khi nhóm nghiên cứu do nhà vật lý Fusa Miyake ở Đại học Nagoya (Nhật Bản) dẫn dắt đã xác định niên đại về sự biến động của mức carbon-14 trong vòng gỗ hằng năm của cây tuyết tùng Nhật Bản vào năm 774–5 SCN. Nghiên cứu tiếp theo đã xác nhận biến động trên xuất hiện trong các mẫu gỗ trên khắp thế giới trong giai đoạn này, đồng thời xác định được ít nhất năm biến động mức carbon-14 khác từ năm 7176 TCN. Các nhà nghiên cứu đã liên hệ sự biến động này với hoạt động của bão mặt trời, nhưng giả thuyết này vẫn còn được xem xét.
Dù nguyên nhân là gì, những “sự kiện Miyake” đã giúp các nhà nghiên cứu xác định chính xác niên đại cổ vật bằng gỗ, thông qua việc phát hiện một sự kiện Miyake cụ thể, sau đó đếm số vòng gỗ hình thành từ đó. Kuitems cho biết, họ thậm chí có thể xác định mùa chặt cây dựa trên độ dày của vòng ngoài cùng.
Các nhà khảo cổ hiện đang áp dụng phương pháp trên cho các khu định cư thời kỳ Đồ đá mới và địa điểm phun trào núi lửa, Dee cũng hy vọng sẽ áp dụng nó để nghiên cứu đế chế Maya ở Trung Mỹ cổ đại. Trong thập kỷ tới, Dee kỳ vọng “sẽ có những tài liệu chính xác đến từng năm về nhiều nền văn minh cổ đại, và chúng ta có thể nói về lịch sử phát triển của chúng… ở quy mô thực sự chuẩn”.
6. Chuyển hóa đơn bào
Chuyển hóa chất học (Metabolomics) – nghiên cứu về lipid, carbohydrate và các phân tử nhỏ khác tác động đến tế bào – ban đầu là một tập hợp các phương pháp mô tả các chất chuyển hóa trong quần thể tế bào hoặc mô, nhưng hiện đang chuyển sang cấp độ đơn bào. Các nhà khoa học có thể sử dụng dữ liệu ở cấp độ tế bào như vậy để làm rõ chức năng phức tạp trong các quần thể tế bào dường như giống hệt nhau. Nhưng quá trình này đặt ra nhiều thách thức.
Các chất chuyển hóa trong tế bào gồm rất nhiều các phân tử có tính chất hóa học đa dạng. Theodore Alexandrov, nhà nghiên cứu về chuyển hóa chất tại Phòng thí nghiệm Sinh học Phân tử châu Âu (Đức) cho biết, một số trong đó tồn tại rất ngắn ngủi với tốc độ luân chuyển chưa đầy một giây. Rất khó để phát hiện chúng: nếu giải trình tự RNA đơn bào có thể thu được gần một nửa số phân tử RNA trong một tế bào hoặc sinh vật (hệ phiên mã) thì hầu hết các phân tích trao đổi chất chỉ thu được một phần rất nhỏ các chất chuyển hóa của tế bào. Thông tin khuyết thiếu này có thể chứa đựng những hiểu biết sinh học quan trọng.
Nhiều phòng thí nghiệm về chuyển hóa chất học đã nghiên cứu về các tế bào phân tách được đặt trong các mao mạch và phân tích riêng lẻ bằng phương pháp khối phổ. Ngược lại, các phương pháp “khối phổ hình ảnh” thu thập thông tin không gian về cách sản xuất chất chuyển hóa tế bào ở các vị trí khác nhau trong một mẫu. Chẳng hạn, các nhà nghiên cứu có thể sử dụng phương pháp giải hấp thụ/ion hóa laser hỗ trợ ma trận (MALDI), trong đó một chùm tia laser quét qua một lát mô được xử lý đặc biệt, giải phóng các chất chuyển hóa để tiếp tục phân tích bằng phép đo khối phổ. Phương pháp này cũng giúp xác định các tọa độ không gian mà các chất chuyển hóa xuất hiện.
Sweedler cho biết, về lý thuyết, cả hai phương pháp đều có thể định lượng hàng trăm hợp chất trong hàng nghìn tế bào, nhưng điều này đòi hỏi phải có phần cứng hàng đầu, đặc chế trị giá hàng triệu USD.
Giờ đây, các nhà nghiên cứu đang làm cho công nghệ mới thích ứng với thiết bị có sẵn. Năm 2021, nhóm của Alexandrov đã giới thiệu SpaceM, một công cụ phần mềm nguồn mở sử dụng dữ liệu hình ảnh kính hiển vi quang học, cho phép xác định tọa độ của các chất chuyển hóa bằng máy quang phổ khối thương mại tiêu chuẩn.
Họ đã sử dụng SpaceM để tìm hiểu về hàng trăm chất chuyển hóa từ hàng chục nghìn tế bào người và chuột, đồng thời sử dụng các phương pháp phiên mã đơn bào tiêu chuẩn để phân loại các tế bào đó thành các nhóm. Alexandrov đặc biệt hào hứng với khía cạnh thứ hai và ý tưởng lắp ráp các “bản đồ trao đổi chất” – tương tự như những bản đồ được phát triển cho phiên mã – để đẩy nhanh tiến độ trong lĩnh vực này. “Nó sẽ mở rộng biên giới [lĩnh vực này] trong tương lai”, anh nói.
7. Mô hình phôi trong ống nghiệm
Các nhà khoa học đã lập bản đồ chi tiết về quá trình từ trứng đã thụ tinh cho đến phôi hoàn chỉnh ở cấp độ tế bào người và chuột nhưng họ vẫn chưa hiểu rõ sự thúc đẩy của cỗ máy phân tử trong các giai đoạn đầu quá trình này. Giờ đây, các mô hình “phôi thai” đang góp phần lấp đầy những khoảng trống, giúp họ hiểu rõ hơn về các sự kiện quan trọng ban đầu có thể quyết định thành công hoặc thất bại của quá trình phát triển bào thai.
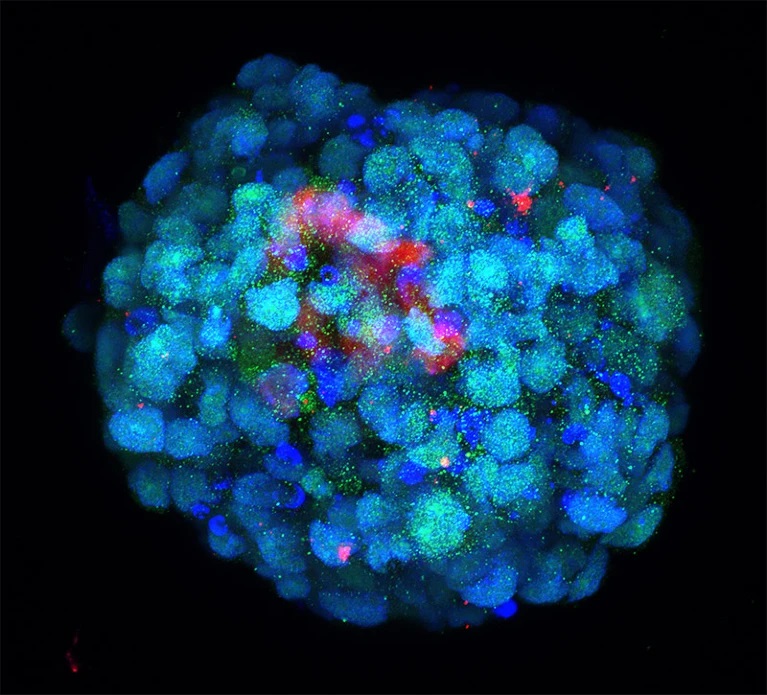
Một phôi hình thành từ các tế bào được chỉnh sửa tương tự như một phôi ở giai đoạn tám tế bào. Nguồn: M.A Mazid et al./ Naturre.
Một số mô hình phức tạp nhất xuất phát từ phòng thí nghiệm của Magdalena Zernicka-Goetz, nhà sinh vật học phát triển tại Viện Công nghệ California ở Pasadena và Đại học Cambridge, Vương quốc Anh. Vào năm 2022, cô và nhóm các cộng sự đã chứng minh có thể tạo ra phôi chuột hoàn chỉnh ở giai đoạn làm tổ từ các tế bào gốc phôi (ES).
Giống như mọi tế bào gốc đa năng, tế bào ES có thể hình thành bất kỳ loại tế bào hoặc mô nào — nhưng chúng cần tương tác chặt chẽ với hai loại tế bào ngoại phôi để hoàn thành quá trình phát triển phôi bình thường. Nhóm nghiên cứu của cô kích thích các tế bào ES hình thành các tế bào ngoại phôi, và nuôi cấy chúng với các tế bào ES để tạo ra các mô hình phôi phát triển đến những giai đoạn mà trước đây không thể đạt được trong ống nghiệm. Nhóm nghiên cứu đã sử dụng mô hình này để phát hiện những thay đổi trong gene riêng lẻ có thể cản trở sự phát triển bình thường của phôi thai như thế nào.
Tại Viện Y sinh và Y tế Quảng Châu (Viện Hàn lâm Khoa học Trung Quốc), nhà sinh vật học tế bào gốc Miguel Esteban và đồng nghiệp đang tiến hành giải pháp khác: tái lập trình tế bào gốc của con người để mô hình hóa các giai đoạn phát triển sớm nhất. “Chúng tôi khởi đầu với ý tưởng có thể tạo ra hợp tử”, Estaban nói. Mặc dù không hoàn toàn làm được điều này, họ đã xác định được phương pháp nuôi cấy có thể đưa các tế bào gốc này trở lại giống như phôi người với tám tế bào. Đây là một dấu mốc phát triển quan trọng, liên quan đến sự thay đổi lớn trong biểu hiện gene, tạo ra các dòng tế bào phôi và tế bào ngoại phôi riêng biệt.
Nhìn chung, những mô hình này có thể giúp các nhà nghiên cứu lập bản đồ về quá trình một vài tế bào tạo nên sự phức tạp đáng kinh ngạc của cơ thể động vật có xương sống. □
Thanh An – Anh Thư dịch
Nguồn: https://www.nature.com/articles/d41586-023-00178-y
Nguồn: Tạp chí Tia sáng